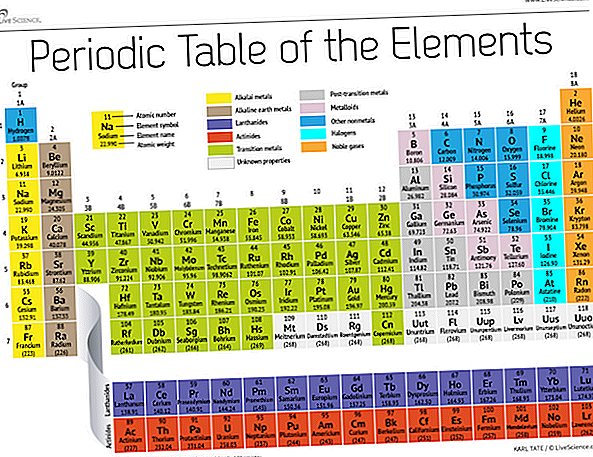
På slutten av 1800-tallet publiserte den russiske kjemikeren Dmitri Mendeleev sitt første forsøk på å gruppere kjemiske elementer i henhold til atomvektene deres. Det var bare rundt 60 elementer kjent på den tiden, men Mendeleev innså at når elementene var organisert etter vekt, skjedde visse typer elementer med jevne mellomrom eller perioder.
I dag, 150 år senere, kjenner kjemikere offisielt 118 elementer (etter tilskudd av fire nykommere i 2016) og bruker fortsatt Mendeleevs periodiske elementtabell for å organisere dem. Tabellen starter med det enkleste atomet, hydrogen, og organiserer deretter resten av elementene etter atomnummer, som er antall protoner som hver inneholder. Med en håndfull unntak tilsvarer rekkefølgen på elementene den økende massen til hvert atom.
Tabellen har syv rader og 18 kolonner. Hver rad representerer en periode; periodetallet til et element indikerer hvor mange av dets energinivåer huser elektroner. Natrium sitter for eksempel i den tredje perioden, noe som betyr at et natriumatom vanligvis har elektroner i de tre første energinivåene. Når man beveger seg nedover bordet, er periodene lengre fordi det tar flere elektroner å fylle de større og mer komplekse ytre nivåene.
Kolonnene i tabellen representerer grupper eller familier av elementer. Elementene i en gruppe ser og oppfører seg ofte på samme måte, fordi de har samme antall elektroner i deres ytterste skall - ansiktet de viser for verden. Gruppe 18-elementer, helt til høyre på bordet, har for eksempel helt fulle ytre skall og deltar sjelden i kjemiske reaksjoner.
Elementer er typisk klassifisert som enten metall eller ikke-metall, men skillelinjen mellom de to er uklar. Metallelementer er vanligvis gode ledere av strøm og varme. Undergruppene i metallene er basert på de samme egenskapene og kjemiske egenskapene til disse samlingene. Vår beskrivelse av den periodiske tabellen bruker ofte aksepterte grupperinger av elementer, i følge Los Alamos National Laboratory.
Alkalimetaller: Alkalimetallene utgjør det meste av gruppe 1, tabellens første kolonne. Disse metallene er blanke og myke nok til å skjære med en kniv. De begynner med litium (Li) og slutter med francium (Fr). De er også ekstremt reaktive og vil briste i flamme eller til og med eksplodere ved kontakt med vann, så kjemikere lagrer dem i oljer eller inerte gasser. Hydrogen, med sitt enkeltelektron, lever også i gruppe 1, men gassen regnes som en ikke-metallisk.
Alkaliske jordartsmetaller: Jordalkalimetallene utgjør gruppe 2 i det periodiske systemet, fra beryllium (Be) til radium (Ra). Hvert av disse elementene har to elektroner i sitt ytterste energinivå, noe som gjør at jordalkalene er reaktive nok til at de sjelden finnes alene i naturen. Men de er ikke så reaktive som alkalimetallene. Deres kjemiske reaksjoner forekommer typisk saktere og produserer mindre varme sammenlignet med alkalimetallene.
lanthanides: Den tredje gruppen er altfor lang til å passe inn i den tredje kolonnen, så den blir brutt ut og vendt sidelengs for å bli øverste rad på øya som flyter nederst på bordet. Dette er lantanidene, elementene 57 til 71 - lantan (La) til lutetium (Lu). Elementene i denne gruppen har en sølvfarget hvit farge og sverter ved kontakt med luft.
oktinidene: Aktinidene stiller øynens nederste rad og består av elementene 89, actinium (Ac), gjennom 103, lawrencium (Lr). Av disse elementene er det bare thorium (Th) og uran (U) som forekommer naturlig på jorden i betydelige mengder. Alle er radioaktive. Aktinidene og lanthanidene danner sammen en gruppe som kalles de indre overgangsmetallene.
Overgangsmetaller: Når vi vender tilbake til hoveddelen av tabellen, representerer resten av gruppe 3 til 12 resten av overgangsmetallene. Disse elementene er harde, men formbare, skinnende og har god ledningsevne. Det er hva du vanligvis tenker på når du hører ordet metall. Mange av de største hitene i metallverdenen - inkludert gull, sølv, jern og platina - bor her.
Metaller etter overgang: I forkant av hoppet inn i den ikke-metale verden er delte egenskaper ikke pent delt langs vertikale gruppelinjer. Metallene etter overgangen er aluminium (Al), gallium (Ga), indium (In), thallium (Tl), tinn (Sn), bly (Pb) og vismut (Bi), og de spenner over gruppe 13 til gruppe 17. Disse elementene har noen av de klassiske egenskapene til overgangsmetallene, men de har en tendens til å være mykere og oppføre seg dårligere enn andre overgangsmetaller. Mange periodiske tabeller har en fet "trappelinje" under den diagonale koblingsbor med astatin. Metallene etter overgangen klynger seg nederst til venstre på denne linjen.
metalloider: Metalloidene er bor (B), silisium (Si), germanium (Ge), arsen (As), antimon (Sb), tellurium (Te) og polonium (Po). De danner trappen som representerer den gradvise overgangen fra metaller til ikke-metaller. Disse elementene oppfører seg noen ganger som halvledere (B, Si, Ge) i stedet for som ledere. Metalloider kalles også "semimetaller" eller "dårlige metaller."
ikke-metaller: Alt annet øverst til høyre på trappen - pluss hydrogen (H), strandet langt tilbake i gruppe 1 - er en ikke-metallisk. Disse inkluderer karbon (C), nitrogen (N), fosfor (P), oksygen (O), svovel (S) og selen (Se).
halogener: De fire øverste elementene i gruppe 17, fra fluor (F) til astatin (At), representerer en av to undergrupper av ikke-metallene. Halogenene er ganske kjemisk reaktive og har en tendens til å pare seg sammen med alkalimetaller for å produsere forskjellige typer salt. Bordsaltet på kjøkkenet ditt er for eksempel et ekteskap mellom alkalimetallnatrium og halogenklor.
Edelgasser: Fargeløse, luktfrie og nesten fullstendig ikke-reaktive, de inerte eller edle gassene runder bordet i gruppe 18. Mange kjemikere forventer at Oganesson, et av de fire nylig navngitte elementene, vil dele disse egenskapene; fordi dette elementet har en halveringstid på millisekundene, har ingen imidlertid klart å teste det direkte. Oganesson fullfører den syvende perioden i den periodiske tabellen, så hvis noen klarer å syntetisere element 119 (og løpet for å gjøre det allerede er i gang), vil det løpe rundt for å starte rad åtte i alkalimetallsøylen.
På grunn av den sykliske natur som er skapt av periodisiteten som gir bordet sitt navn, foretrekker noen kjemikere å visualisere Mendeleevs bord som en sirkel.
Ytterligere ressurser: