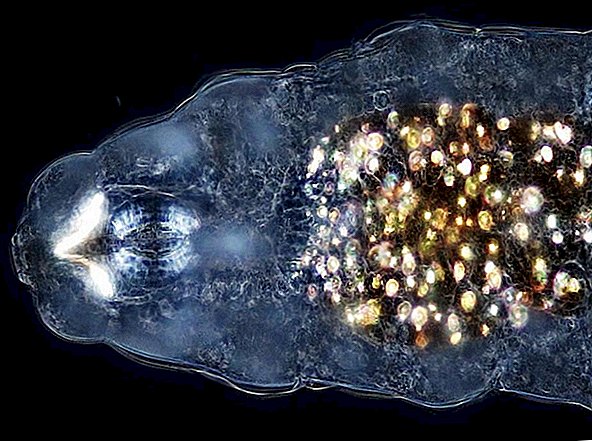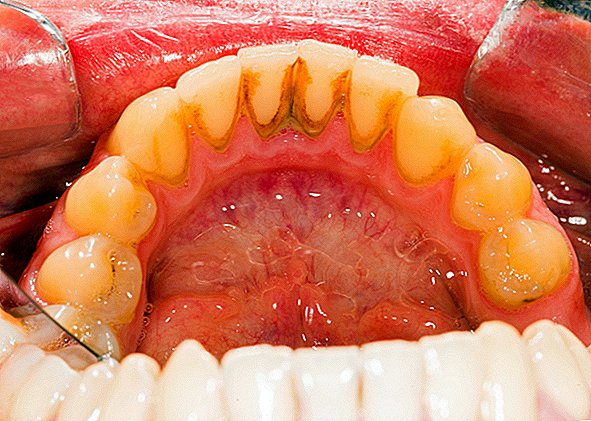
Biofilmer er et kollektiv av en eller flere typer mikroorganismer som kan vokse på mange forskjellige overflater. Mikroorganismer som danner biofilmer inkluderer bakterier, sopp og protister.
Et vanlig eksempel på en biofilm tannplakk, en slimete opphopning av bakterier som dannes på overflatene til tennene. Damskum er et annet eksempel. Det er funnet biofilmer som vokser på mineraler og metaller. De er funnet under vann, under jorden og over bakken. De kan vokse på plantevev og dyrevev, og på implantert medisinsk utstyr som katetre og pacemakere.
Hver av disse distinkte overflatene har et felles definerende trekk: de er våte. Disse miljøene er "periodisk eller kontinuerlig forurenset av vann," ifølge en artikkel fra 2007 publisert i Microbe Magazine. Biofilmer trives på fuktige eller våte overflater.
Biofilmer har etablert seg i slike miljøer i veldig lang tid. Fossilbevis for biofilmer stammer fra cirka 3,25 milliarder år siden, ifølge en artikkel fra 2004 publisert i tidsskriftet Nature Reviews Microbiology. For eksempel er det funnet biofilmer i de 3,2 milliarder år gamle dyphavs hydrotermiske bergartene i Pilbara Craton i Australia. Lignende biofilmer finnes i hydrotermiske miljøer som varme kilder og dyphavsventiler.

Biofilmformasjon
Biofilmdannelse begynner når frittflytende mikroorganismer som bakterier kommer i kontakt med en passende overflate og begynner å legge ned røtter, så å si. Dette første tilknytningstrinnet skjer når mikroorganismer produserer et sløyfet stoff kjent som et ekstracellulært polymert stoff (EPS), ifølge Center for Biofilm Engineering ved Montana State University. En EPS er et nettverk av sukker, proteiner og nukleinsyrer (som DNA). Det gjør det mulig for mikroorganismer i en biofilm å feste seg sammen.
Vedlegg følges av en periode med vekst. Ytterligere lag med mikroorganismer og EPS bygger på de første lagene. Til syvende og sist lager de en bulbøs og kompleks 3D-struktur, i følge Center for Biofilm Engineering. Vann kanaliserer kryss på tvers av biofilmer og gir mulighet for utveksling av næringsstoffer og avfallsprodukter, ifølge artikkelen i Microbe.
Flere miljøforhold hjelper til med å bestemme i hvilken grad en biofilm vokser. Disse faktorene avgjør også om det er laget av bare noen få celler med celler eller betydelig mer. "Det avhenger virkelig av biofilmen," sa Robin Gerlach, professor i avdeling for kjemisk og biologisk teknikk ved Montana State University-Bozeman. For eksempel kan mikroorganismer som produserer en stor mengde EPS vokse til ganske tykke biofilmer selv om de ikke har tilgang til mye næringsstoffer, sa han. På den annen side, for mikroorganismer som er avhengige av oksygen, kan mengden tilgjengelig begrense hvor mye de kan vokse. En annen miljøfaktor er begrepet "skjærspenning". "Hvis du har en veldig høy flyt over en biofilm, som i en bekk, er biofilmen vanligvis ganske tynn. Hvis du har en biofilm i langsomt rennende vann, som i et tjern, kan det bli veldig tykt," forklarte Gerlach.
Endelig kan cellene i en biofilm forlate bretten og etablere seg på en ny overflate. Enten bryter en klump av celler seg bort, eller så sprenger individuelle celler seg ut av biofilmen og oppsøker et nytt hjem. Denne sistnevnte prosess er kjent som "sående spredning" ifølge Center for Biofilm Engineering.
Hvorfor danne en biofilm?
For mikroorganismer har det visse fordeler å leve som en del av en biofilm. "Fellesskap av mikrober er vanligvis mer motstandsdyktige mot stress," sa Gerlach til Live Science. Potensielle stressfaktorer inkluderer mangel på vann, høy eller lav pH, eller tilstedeværelsen av stoffer som er giftige for mikroorganismer som antibiotika, antimikrobielle stoffer eller tungmetaller.
Det er mange mulige forklaringer på hardheten til biofilmer. For eksempel kan det slimete EPS-dekselet fungere som en beskyttende barriere. Det kan bidra til å forhindre dehydrering eller fungere som et skjold mot ultrafiolett (UV) lys. Også skadelige stoffer som antimikrobielle stoffer, blekemiddel eller metaller blir enten bundet eller nøytralisert når de kommer i kontakt med EPS. Dermed blir de fortynnet til konsentrasjoner som ikke er dødelige i god tid før de kan nå forskjellige celler dypt inne i biofilmen, ifølge en artikkel fra 2004 i Nature Reviews Microbiology.
Fortsatt er det mulig for visse antibiotika å trenge gjennom EPS og komme seg gjennom en biofilms lag. Her kan en annen beskyttelsesmekanisme komme i spill: tilstedeværelsen av bakterier som er fysiologisk sovende. For å fungere bra, krever alle antibiotika et visst nivå av cellulær aktivitet. Så hvis bakterier er fysiologisk sovende til å begynne med, er det ikke mye for et antibiotikum å forstyrre.
En annen metode for beskyttelse mot antibiotika er tilstedeværelsen av spesielle bakterieceller kjent som "persisters." Slike bakterier deler seg ikke og er resistente mot mange antibiotika. I følge en artikkel fra 2010 publisert i tidsskriftet Cold Spring Harbor Perspectives in Biology, fungerer "persisters" -funksjonen ved å produsere stoffer som blokkerer målene for antibiotika.
Generelt drar mikroorganismer som lever sammen som en biofilm fordel av tilstedeværelsen av deres forskjellige samfunnsmedlemmer. Gerlach siterte eksemplet på autotrofiske og heterotrofiske mikroorganismer som lever sammen i biofilmer. Autotrofer, for eksempel fotosyntetiske bakterier eller alger, er i stand til å produsere sin egen mat i form av organisk (karbonholdig) materiale, mens heterotrofer ikke kan produsere sin egen mat og krever utenfor kilder til karbon. "I disse multiorganismesamfunnene krysser de ofte fôr," sa han.
Biofilmer og oss
Gitt det enorme spekteret av miljøer der vi møter biofilmer, er det ingen overraskelse at de påvirker mange aspekter av menneskelivet. Nedenfor er noen eksempler.

Helse og sykdom
Etter hvert som forskningen har utviklet seg gjennom årene, har biofilmer - bakteriell og sopp - blitt implisert i en rekke helsemessige forhold. I en oppfordring fra 2002 om tilskuddsansøkninger bemerket National Institute of Health (NIH) at biofilmer utgjorde "for over 80 prosent av mikrobielle infeksjoner i kroppen."
Biofilmer kan vokse på implanterte medisinske apparater som protesiske hjerteventiler, leddproteser, katetre og pacemakere. Dette fører igjen til infeksjoner. Fenomenet ble først bemerket på 1980-tallet da biofilmer ble funnet på intravenøse katetre og pacemakere. Bakterielle biofilmer har også vært kjent for å forårsake infektiv endokarditt og lungebetennelse hos de med cystisk fibrose, ifølge artikkelen fra 2004 i Nature Reviews Microbiology, blant andre infeksjoner.
"Årsaken til at biofilmdannelse er en stor årsak til bekymring er at i en biofilm er bakterier mer motstandsdyktige mot antibiotika og andre store desinfeksjonsmidler som du kan bruke for å kontrollere dem," sa AC Matin, professor i mikrobiologi og immunologi ved Stanford Universitet. Faktisk, sammenlignet med frittflytende bakterier, kan de som vokser som en biofilm være opptil 1500 ganger mer resistente mot antibiotika og andre biologiske og kjemiske midler, ifølge artikkelen i Microbe. Matin beskrev biofilmresistens kombinert med den generelle økningen i antibiotikaresistens blant bakterier som en "double whammy" og en stor utfordring for å behandle infeksjoner.
Soppbiofilmer kan også forårsake infeksjoner ved å vokse på implanterte enheter. Gjærarter som medlemmene i slekten Candida vokse på brystimplantater, pacemakere og protetiske hjerteklaffer i henhold til en artikkel fra 2014 publisert i tidsskriftet Cold Spring Harbor Perspectives in Medicine. Candida arter vokser også på kroppsvev, noe som fører til sykdommer som vaginitt (betennelse i skjeden) og orofaryngeal candidiasis (en gjærinfeksjon som utvikler seg i munnen eller halsen). Forfatterne bemerker imidlertid at medikamentresistens ikke ble vist i disse tilfellene.
bioremediation
Noen ganger er biofilmer nyttige. "Bioremediation, generelt, er bruk av levende organismer, eller deres produkter - for eksempel enzymer - for å behandle eller nedbryte skadelige forbindelser," sa Gerlach. Han bemerket at biofilmer brukes til å behandle avløpsvann, tungmetallforurensninger som kromat, eksplosiver som TNT og radioaktive stoffer som uran. "Mikrober kan enten forringe dem, eller endre mobilitet eller giftig tilstand og derfor gjøre dem mindre skadelige for miljøet og for mennesker," sa han.
Nitrifisering ved bruk av biofilmer er en form for rensing av avløpsvann. Under nitrifikasjon omdannes ammoniakk til nitrater og nitrater gjennom oksidasjon. Dette kan gjøres av autotrofiske bakterier, som vokser som biofilmer på plastoverflater, ifølge en artikkel fra 2013 publisert i tidsskriftet Water Research. Disse plastoverflatene er bare noen få centimeter store og distribueres gjennom vannet.
Det eksplosive TNT (2,4,6-Trinitrotoluen) regnes som et jord-, overflatevann- og grunnvannsforurensende stoff. Den kjemiske strukturen til TNT består av benzen (en sekskantet aromatisk ring laget av seks karbonatomer) festet til tre nitrogrupper (NO2) og en metylgruppe (CH3). Mikroorganismer forringer TNT ved reduksjon, ifølge en artikkel fra 2007 publisert i tidsskriftet Applied and Environmental Microbiology. De fleste mikroorganismer reduserer de tre nitrogruppene, mens noen angriper den aromatiske ringen. Forskerne - Ayrat Ziganshin, Robin Gerlach og kolleger - fant ut at gjæren tøyer Yarrowia lipolytica var i stand til å nedbryte TNT ved begge metodene, men først og fremst ved å angripe den aromatiske ringen.
Mikrobielle brenselceller
Mikrobielle brenselceller bruker bakterier for å konvertere organisk avfall til elektrisitet. Mikroberne lever på overflaten av en elektrode og overfører elektroner til den, og til slutt skaper en strøm, sa Gerlach. En artikkel fra 2011 publisert i Illumin, et nettmagasin fra University of South California, bemerker at bakterier som driver mikrobielle brenselceller bryter ned mat og kroppslig avfall. Dette gir en billig energikilde og ren bærekraftig energi.
Pågående forskning
Verden vår vrimler av biofilmer. I midten av det 20. århundre ble det faktisk funnet flere bakterier på innsiden av overflatene til containere som inneholdt bakteriekulturer, enn som flyter fritt i selve væskekulturen, ifølge artikkelen fra 2004 i Nature Reviews Microbiology. Å forstå disse komplekse mikrobielle strukturene er et aktivt forskningsområde.
"Biofilmer er fantastiske samfunn. Noen mennesker har sammenlignet dem med flercellede organismer fordi det er mye interaksjon mellom enkeltceller," sa Gerlach. "Vi fortsetter å lære om dem, og fortsetter å lære om hvordan du kan kontrollere dem bedre; både for redusert skade, som innen medisin, eller for økt nytte som i bioremediation. Vi kommer ikke til å gå tom for interessante spørsmål på dette området. "