Det har lenge vært kjent at alle molekyler har to like og motsatte ladninger som er atskilt med en viss avstand. Når det gjelder slike polare molekyler, faller ikke sentrum av negativ ladning sammen med sentrum av positiv ladning. Polaritetsgraden i slike kovalente molekyler kan beskrives med begrepet Dipole Moment, som i det vesentlige er mål på polaritet i en polar kovalent binding.
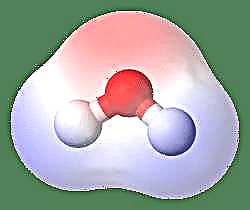
Det enkleste eksemplet på en dipol er et vannmolekyl. Et molekyl med vann er polært på grunn av ulik deling av elektronene i en "bøyd" struktur. Vannmolekylet danner en vinkel, med hydrogenatomer i spissene og oksygen i toppunktet. Siden oksygen har en høyere elektronegativitet enn hydrogen, har siden av molekylet med oksygenatom en delvis negativ ladning mens hydrogenet i sentrum har en delvis positiv ladning. På grunn av dette peker retning av dipolmomentet mot oksygenet.
På fysikkens språk er det elektriske dipolmomentet et mål på separasjonen av positive og negative elektriske ladninger i et ladningssystem, det vil si et mål på ladningssystemets samlede polaritet - dvs. separasjonen av molekylenes elektriske ladning, som fører til en dipol. Matematisk, og i det enkle tilfellet med to punktladninger, en med ladning + q og en med ladning? Q, kan det elektriske dipolmomentet p uttrykkes som: p = qd, hvor d er forskyvningsvektoren som peker fra negativ ladning til den positive ladningen. Dermed peker den elektriske dipolmomentvektoren p fra den negative ladningen til den positive ladningen.
En annen måte å se på det er å representere Dipole Moment med den greske bokstaven m, m = ed, hvor e er den elektriske ladningen og d er separasjonsavstanden. Det er uttrykt i enhetene til Debye og skrevet som D (hvor 1 Debye = 1 x 10-18e.s.u cm). Et dipolmoment er en vektormengde og er derfor representert av en liten pil med en hale i det positive sentrum og hode som peker mot et negativt senter. Når det gjelder et vannmolekyl er Dipol-momentet 1,85 D, mens et molekyl saltsyre er 1,03 D og kan representeres som:
Vi har skrevet mange artikler om dipoløyeblikk for Space Magazine. Her er en artikkel om hva vann er laget av, og her er en artikkel om molekyler.
Hvis du vil ha mer informasjon om dipol-øyeblikk, kan du sjekke ut disse artiklene fra Hyperphysics and Science Daily.
Vi har også spilt inn en hel episode av Astronomy Cast om Molecules in Space. Hør her, avsnitt 116: Molecules in Space.
kilder:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule